在生物醫(yī)藥領(lǐng)域,CAR-T療法正經(jīng)歷著從體外制備到體內(nèi)編程的革命性跨越。2025年成為體內(nèi)CAR-T(in vivo CAR-T)發(fā)展的關(guān)鍵轉(zhuǎn)折點——6月,Capstan公司宣布其基于tLNP載體的體內(nèi)CAR-T療法CPTX2309正式進入Ⅰ期臨床試驗;隨后,艾伯維以21億美元全現(xiàn)金收購Capstan,獲得了其專有tLNP平臺技術(shù)。這筆交易印證了大型藥企對體內(nèi)CAR-T賽道的高度認(rèn)可,也標(biāo)志著該技術(shù)正式從概念驗證邁向臨床開發(fā)新階段。

in vivo CAR-T與tLNP:精準(zhǔn)醫(yī)療的下一個風(fēng)口
行業(yè)背景:從體外到體內(nèi)的革命性跨越
傳統(tǒng)體外CAR-T療法已在B細(xì)胞白血病和淋巴瘤創(chuàng)下了輝煌的里程碑,但其復(fù)雜的制造過程、高昂的費用及毒性等局限成為了這項技術(shù)大面積普及的瓶頸所在。據(jù)行業(yè)調(diào)研,一劑商業(yè)化CAR-T產(chǎn)品的價格高達(dá)37萬至47萬美元,且從細(xì)胞采集到回輸需要耗時3-5周,部分患者因病情快速進展而無法等待。
體內(nèi)CAR-T療法以顛覆性的技術(shù)思路,通過特殊載體將CAR基因直接送入體內(nèi),跳過繁瑣的體外步驟,直接在患者體內(nèi)完成對T細(xì)胞的“裝備升級”。這種“體內(nèi)工廠”模式不僅大幅簡化治療流程,更有望將成本降低至傳統(tǒng)CAR-T的十分之一,成為下一代細(xì)胞免疫治療的破局點。
tLNP:實現(xiàn)體內(nèi)CAR-T的核心遞送系統(tǒng)
在體內(nèi)CAR-T療法的實現(xiàn)路徑中,靶向脂質(zhì)納米顆粒(tLNP)已成為行業(yè)主流技術(shù)路線。tLNP通過在傳統(tǒng)LNP表面修飾特異性靶向配體(如抗體、多肽),賦予其精準(zhǔn)識別并遞送基因貨物至T細(xì)胞的能力。
其核心技術(shù)在于:將靶向抗體精確偶聯(lián)到LNP表面,形成“導(dǎo)航導(dǎo)彈”式遞送系統(tǒng)。當(dāng)tLNP進入體內(nèi)后,表面的靶向配體引導(dǎo)整個納米顆粒與T細(xì)胞特異性結(jié)合,通過內(nèi)吞作用將CAR-mRNA遞送至細(xì)胞內(nèi),實現(xiàn)T細(xì)胞的原位重編程。
DSPE-PEG-MAL:構(gòu)建tLNP的關(guān)鍵“化學(xué)橋梁”
驅(qū)動靶向遞送:tLNP功能化的三重賦能
在構(gòu)建tLNP的復(fù)雜體系中,DSPE-PEG-MAL扮演著動態(tài)的“執(zhí)行者”角色,其結(jié)構(gòu)設(shè)計精準(zhǔn)對應(yīng)了其在制備流程中的關(guān)鍵功能,其作用可分解為以下三個遞進且連貫的步驟。
· 嵌入與錨定:從溶液到膜相的精準(zhǔn)定位
在LNP的自組裝過程中,DSPE-PEG-MAL憑借其DSPE疏水尾的物理化學(xué)性質(zhì),能夠自發(fā)地將其“錨定”在形成中的脂質(zhì)雙層膜上。這一過程確保了整個分子以預(yù)設(shè)的取向和穩(wěn)定的方式成為LNP結(jié)構(gòu)的一部分,為后續(xù)功能奠定了基礎(chǔ)。
· 伸展與保護:在界面上建立空間防線
一旦錨定,親水的PEG2000鏈便充分伸展至LNP周圍的水相環(huán)境中,形成一個柔性的、水化的“刷狀”保護層。此保護層是LNP的“第一道防線”,通過抑制蛋白質(zhì)非特異性吸附和減少顆粒間聚集,延長體內(nèi)循環(huán)半衰期,在復(fù)雜的體內(nèi)環(huán)境中維護LNP的理化穩(wěn)定性與功能性完整性。
· 點擊與賦能:從通用載體到精準(zhǔn)導(dǎo)彈的化學(xué)蛻變
位于PEG鏈末端的馬來酰亞胺(-MAL)基團,是賦予LNP“智慧”的化學(xué)開關(guān)。它作為一個高選擇性的生物偶聯(lián)位點,能夠與經(jīng)過工程化修飾(例如,通過還原二硫鍵或利用SATA等試劑引入)的抗體巰基發(fā)生高效反應(yīng)。正是通過這一步不可逆的共價連接,普通的LNP才被“賦能”,進化為能夠精準(zhǔn)識別特定細(xì)胞表面抗原的靶向tLNP。
|
|
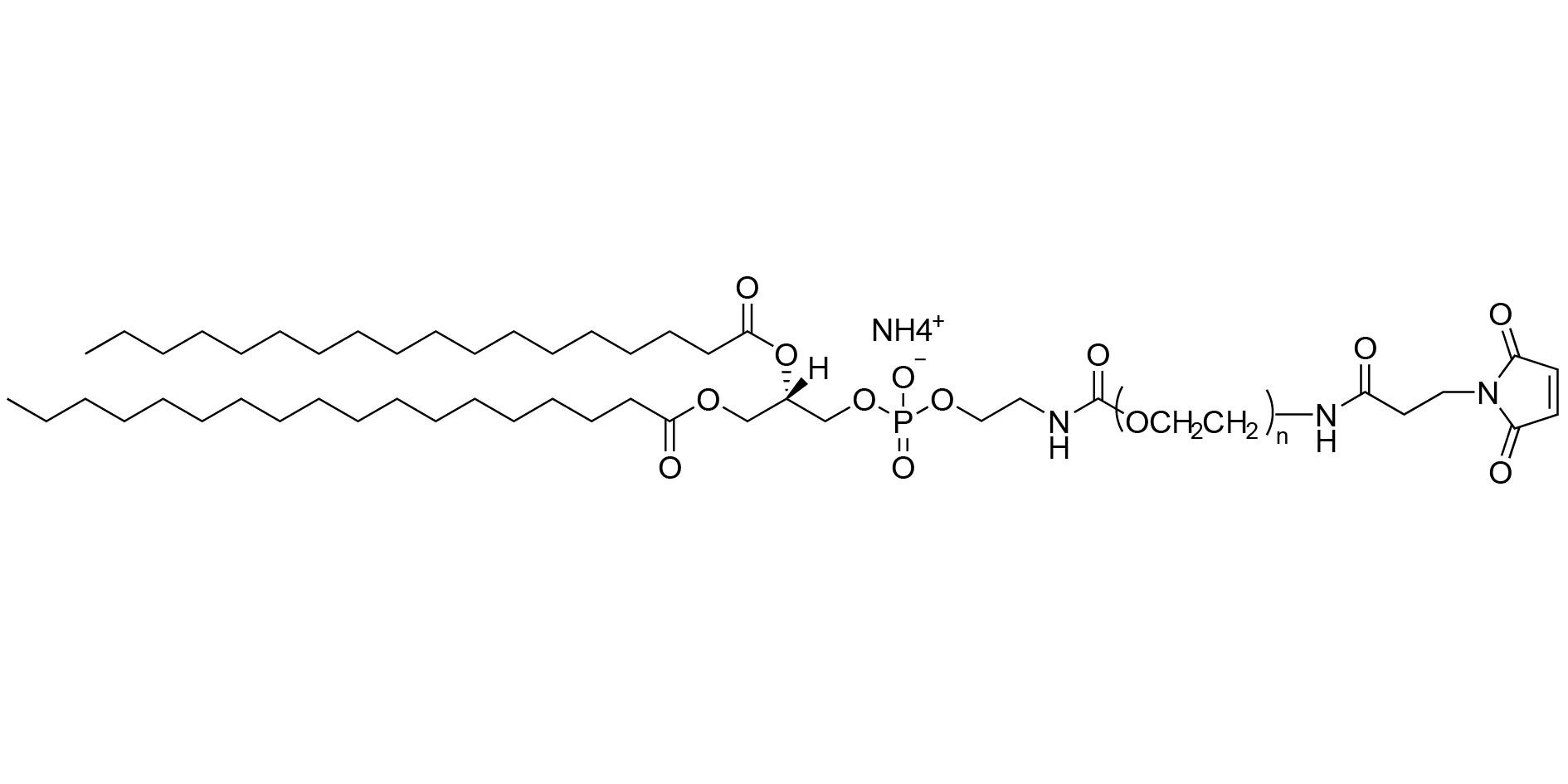
圖1:DSPE-PEG-MAL(銨鹽)的分子結(jié)構(gòu)示意圖
在LNP表面實現(xiàn)抗體偶聯(lián)的技術(shù)路徑
利用DSPE-PEG-MAL在LNP表面實現(xiàn)抗體偶聯(lián),是目前構(gòu)建tLNP最成熟、應(yīng)用最廣泛的策略。這一過程通常涉及三個核心環(huán)節(jié):
1. LNP制備:將DSPE-PEG-MAL與其他脂質(zhì)組分(可電離脂質(zhì)、輔助脂質(zhì)、膽固醇、PEG脂)通過微流控混合技術(shù)制備成LNP,此時DSPE-PEG-MAL的馬來酰亞胺(-MAL)基團暴露在LNP表面。
2. 抗體預(yù)處理:遵循行業(yè)內(nèi)構(gòu)建靶向LNP的常用方法(例如Capstan Therapeutics在專利WO2024249954中所述),將抗體進行巰基(-SH)化修飾,為后續(xù)偶聯(lián)反應(yīng)做準(zhǔn)備。
3. 偶聯(lián)反應(yīng):將巰基(-SH)化抗體與LNP在適宜緩沖液(如PBS,pH 7.4)中低溫(如4°C)孵育(通常為數(shù)小時至過夜),抗體上的巰基與LNP表面的馬來酰亞胺(-MAL)基團共價結(jié)合,完成靶向功能化修飾。
與慢病毒、腺相關(guān)病毒等病毒載體相比,基于DSPE-PEG-MAL的LNP遞送系統(tǒng)具有低免疫原性、無插入突變風(fēng)險、易規(guī)模化生產(chǎn)等優(yōu)勢,成為體內(nèi)CAR-T理想載體。
賽諾邦格GMP級DSPE-PEG-MAL核心優(yōu)勢
GMP級生產(chǎn)與現(xiàn)貨供應(yīng)
在當(dāng)前in vivo CAR-T研發(fā)浪潮中,高質(zhì)量、可穩(wěn)定供應(yīng)的關(guān)鍵輔料是確保研發(fā)順利推進的基石。廈門賽諾邦格已建立完整的GMP質(zhì)量管理體系,成功實現(xiàn)DSPE-PEG-MAL的GMP級別規(guī)模化生產(chǎn),并建立充足現(xiàn)貨庫存。
即將完成CDE與DMF雙備案
為更好地助力客戶藥品注冊申報,我們的DSPE-PEG-MAL產(chǎn)品正在積極推進:
· 中國CDE輔料登記備案:完成后可直接關(guān)聯(lián)用于藥品注冊申請
· 美國FDA DMF備案:提供向FDA證明輔料質(zhì)量和合規(guī)性的權(quán)威依據(jù),
賽諾邦格從原料源頭、合成工藝到純化控制,建立了一套完整的質(zhì)控體系。我們深知,對于in vivo CAR-T這類前沿療法而言,輔料的任何微小差異都可能對最終制劑的理化性質(zhì)、體內(nèi)行為乃至治療效果產(chǎn)生巨大影響。我們不僅對純度、馬來酰亞胺(-MAL)基團的活性以及PEG鏈的完整性進行嚴(yán)格控制,更是基于多年來對PEG及活性衍生物工業(yè)化生產(chǎn)的深刻理解以及多個IND項目的申報經(jīng)驗,開發(fā)了一系列特異性表征檢測項,這些深入的理化性質(zhì)表征所構(gòu)成的差異化優(yōu)勢,能為您的項目申報提供更全面的數(shù)據(jù)支持。雙備案完成后,客戶可直接引用我們的備案號,大幅簡化IND(新藥臨床試驗申請)或NDA(新藥上市申請)申報流程,節(jié)省時間和人力成本,顯著提升項目申報成功率。
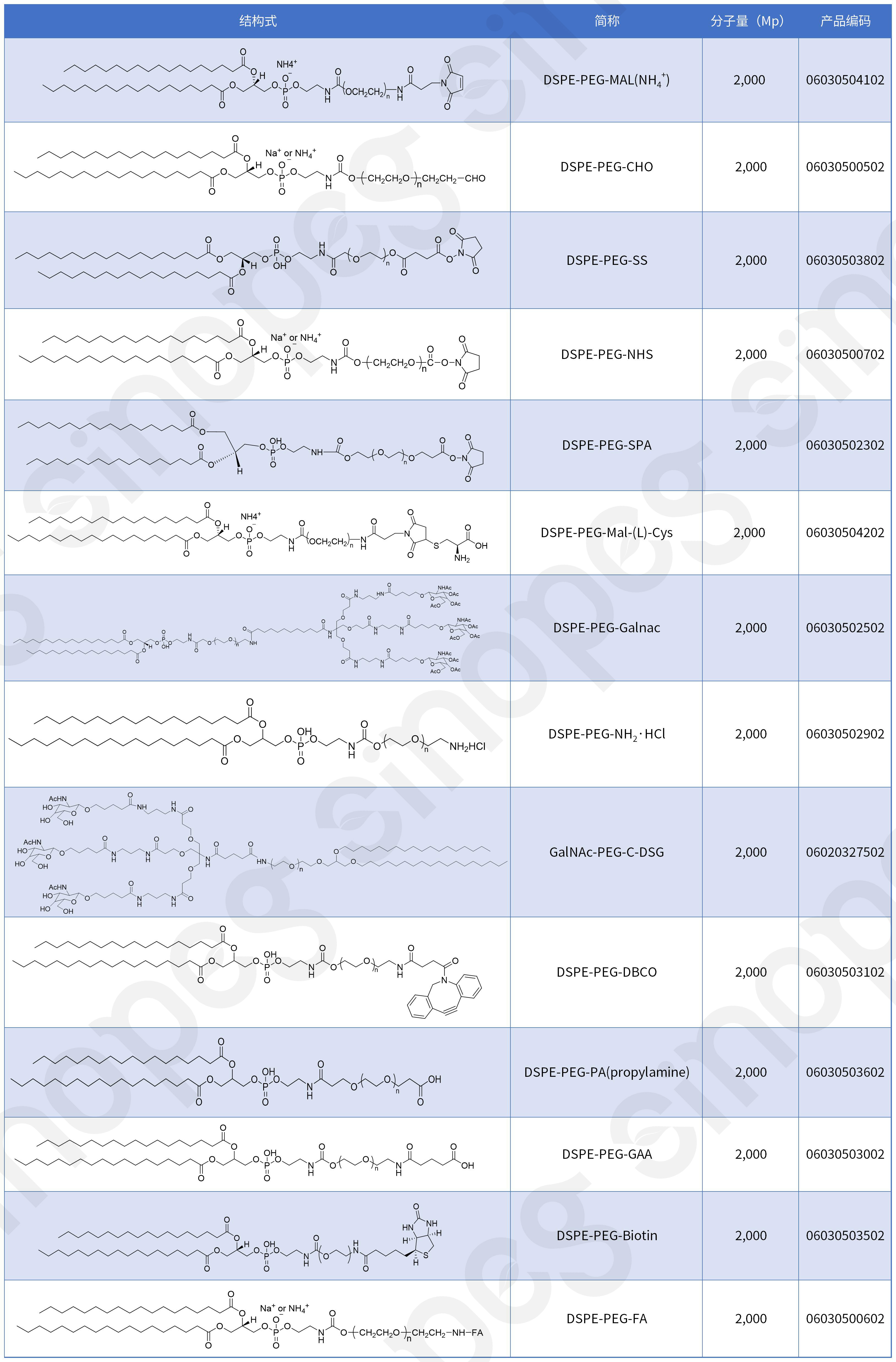
DSPE-PEG系列產(chǎn)品擴展
除了DSPE-PEG-MAL,我司還可提供多種功能化磷脂-PEG衍生物的定制開發(fā)服務(wù),滿足不同研發(fā)需求:
Reference:
1. Capstan Therapeutics. Capstan Therapeutics Announces Initiation of Phase 1 Trial of Lead In Vivo CAR-T Therapy, CPTX2309, for Treating Autoimmune Disease. Business Wire. 2025 June 11.
2. AbbVie. AbbVie to Acquire Capstan Therapeutics, Further Strengthening Commitment to Transforming Patient Care in Immunology. AbbVie News Center. 2025 June 30.
3. American Society of Clinical Oncology. CAR-T Cell Therapy: Costs and Considerations. ASCO Annual Meeting Proceedings. 2024.
4. Smith J, et al. In vivo CAR-T cells demonstrate potent anti-tumor activity with reduced manufacturing complexity. Nature Biotechnology. 2023;41(5):678-685.
5. Wang D, et al. Targeted lipid nanoparticles for in vivo T cell engineering. Science Advances. 2024;10(12):eadl2165.
6. Chen X, et al. Antibody-conjugated LNP for precise in vivo gene delivery to T cells. Cell Reports Medicine. 2024;5(3):101489.
7. Zhang Y, et al. Molecular structure and membrane anchoring properties of DSPE-PEG lipids. Biochimica et Biophysica Acta. 2023;1865(4):184321.
8. Gabizon A, et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Research. 1994;54:987-992.
9. Hermanson GT. Bioconjugate Techniques. 3rd ed. Academic Press; 2021.
10. Wei X, et al. Microfluidic synthesis of targeted lipid nanoparticles for T cell engineering. Lab on a Chip. 2024;24(8):2156-2168.
11. Kato T, et al. Efficient antibody conjugation using Traut's reagent for LNP functionalization. Bioconjugate Chemistry. 2023;34(7):1256-1265.
12. Li M, et al. Covalent conjugation of antibodies to LNP surface for targeted delivery. Journal of Controlled Release. 2024;368:456-467.
13. Xu Q, et al. Non-viral delivery systems for in vivo CAR-T cell engineering. Nature Reviews Materials. 2024;9(3):189-205.